Correo Científico Médico de Holguín 2003;7(1)
Facultad de Ciencias Médicas “Mariana Grajales” Holguín
Purificación
de IgG de Conejo por cromatografía de Intercambio Iónico y de afinidad
Purification of rabbit IgG
by ion exchange and affinity
chromatography.
Maritza Ulloa Román1,
Beatriz Cruz Castellanos2, Elizabeth Guilarte
Barinaga3, Tamahara Fernández Iglesias 4, Luis
Escalona Fernández5
1 Máster en Biotecnología.
Profesora Auxiliar. Instituto Superior Pedagógico "José de la Luz y Caballero"
2 Lic. en Química.
Laboratorio de Biotecnología CITMA. Holguín
3 Lic. en Química. Facultad de Ciencias Médicas "Mariana Grajales"
4 Máster en Didáctica de la Química. Asistente. Instituto Superior
Pedagógico "José de la Luz y Caballero"
5 Máster en Didáctica de la Matemática. Asistente. Facultad de
Ciencias Médicas "Mariana Grajales"
RESUMEN
La purificación
de IgG de conejo es un paso importante durante la
obtención de antisueros para uso clínico. En el
presente trabajo se estudiaron dos
procedimientos para realizar el proceso:
la cromatografía de Intercambio iónico en DEAE-Celulosa y la cromatografía
de afinidad en Proteína A- Sepharosa Fast
Flow, ambos con previa precipitación con sulfato
de amonio al 50 % de saturación. Se diseñó un experimento para la optimización
de la purificación de IgG mediante cromatografía de intercambio iónico
obteniéndose como parámetros óptimos, los valores de 21 cm/h para la velocidad
de flujo y un volumen de suero de 8 ml. Se obtuvieron
resultados similares de pureza y recobrado para la cromatografía de afinidad
y la de intercambio iónico, recomendándose esta última por su bajo costo y
satisfactorios resultados para la utilización diaria en la purificación de
IgG de conejo.
Descriptores:
IgG de conejo, Antisueros, Purificación,
Cromatografía.
ABSTRACTS
Purification of rabbit IgG
is an important step for antiserum production for clinical use. In this paper,
two procedures were studied: ion exchange chromatography using DEAE-Cellulose
and affinity chromatography using Protein A- Sepharosa
Fast Flow. Both experiments use a first step by means of ammonium sulfate
precipitation. A factorial experiment was developed for the optimization of
IgG purification from rabbit serum. Flow rate of 21 cm/h and
serum 8 ml were selected as the best conditions for rabbit IgG purification. Similar results of recovery and purity were
obtained in affinity chromatography and ion exchange chromatography. The last
procedure is recommended by these results for usual rabbit IgG purification.
Key words: Rabbit IgG, purification, chromatography, antiserum.
INTRODUCCIÓN
Durante la producción de antisueros se obtienen en el suero de los animales inmunizados, altos títulos de anticuerpos contra el antígeno empleado. Es la fracción de las IgG generalmente, la responsable fundamental de la respuesta inmune alcanzada.
Entre los métodos
cromatográficos más empleados para la purificación
de IgG se
encuentran la cromatografía de intercambio iónico (1,2,3)
y la de afinidad (4,5) y, como caso particular de esta última,
la cromatografía en proteína A -Sepharosa (6,7,8).
. Por lo general se logran mejores resultados cuando se combinan diferentes
métodos(7,9).El presente trabajo se encaminó hacia
el montaje y optimización de técnicas que permitan contar con un método de
trabajo para la purificación de IgG a partir de
suero de conejo, económicamente factible y con un grado de pureza adecuado.
MATERIALES Y MÉTODOS
Para la realización
de nuestro trabajo se utilizaron sueros de conejo normal e inmunizado provenientes
del Centro Provincial de Higiene y Epidemiología de Holguín.
Se trabajaron
dos esquemas de purificación. El primero se realizó mediante la precipitación
con sulfato de amonio al 50 % de saturación, posterior desalinización del
precipitado mediante diálisis y cromatografía
de intercambio iónico en DEAE-Celulosa DE-52 (Wahtman), a partir de una modificación del método propuesto
por Mayer (3).
El segundo, se
inició igualmente con precipitación salina y diálisis y culmina con cromatografía
de afinidad en Proteína A- Sepharosa Fast
Flow (Pharmacia), adecuando el método
propuesto para IgG de ratón (6).
Para la purificación
de IgG de conejo por intercambio
iónico se realizó un experimento con un diseño factorial 2n con el objetivo de optimizar la velocidad de
flujo y el volumen de suero. Se realizaron 4 experimentos para los que se
seleccionaron los valores máximos y mínimos de cada variable y cuyo orden
de realización se determinó aleatoriamente (10). La tabla 1 muestra
los datos de los valores utilizados durante la
realización de los experimentos.
Se hizo la cuantificación
de proteínas por el método de Lowry (11)
y como criterio de pureza se utilizó la inmunoelectroforesis
(1).
RESULTADOS
Una vez realizados
los cuatro experimentos de purificación de IgG de
conejo por cromatografía de intercambio iónico, para cada uno de ellos se
obtuvo el gráfico de absorbancia contra volumen de elución
de la columna que se muestra en la figura 1.
En la tabla 1
se muestran los datos de cuantificación de proteínas en el suero y
los picos para cada experimento, así como el recobrado obtenido en cada caso.
Se puede observar que el mejor valor de recobrado se obtiene para el experimento
4. Se analizó la inmunoelectroforesis realizada
a dicho pico y se encontró una sola banda de precipitación que corresponde
por su migración a las IgG, obteniéndose resultados
similares en cuanto a pureza en los diferentes experimentos.
La figura 2 muestra
el cromatograma correspondiente a la purificación
de IgG de suero de conejo normal mediante cromatografía
de afinidad en Proteína A- Sepharosa Fast Flow. El primer pico corresponde a las proteínas no enlazadas
que eluyen con el buffer inicial (Glicina 1,5 mol/l,
NaCl 3 mol/l pH=8,9). La IgG de conejo eluye con el buffer
citrato 0,1 mol/l pH=4 que corresponde
al segundo pico. El tercer pico contiene una pequeña fracción de IgG fuertemente enlazada a la columna y que se elimina al
lavar la misma con buffer citrato pH=3. Al
comprobar la pureza de la IgG mediante la inmunoelectroforesis, se obtuvieron resultados similares a
los anteriores con una sola banda de precipitación.
A continuación
se aplicaron ambos métodos para la purificación de suero de un conejo que
había sido inmunizado con suero de ratón para obtener IgG
de conejo anti-ratón.
La tabla 2 muestra los resultados comparativos de estas dos purificaciones. Se puede observar que los valores de concentración de IgG en el pico, así como el recobrado obtenido son similares. De igual forma, mediante la inmunoelectroforesis se comprobó la pureza de ambas con análogos resultados.
Tabla 1.Comparación de los
resultados de las corridas del experimento realizado para la cromatografía
de intercambio iónico en DEAE-Celulosa
Orden de Volumen Velocidad Concentración Concentración Recobrado |
Ejecución (ml) (ml/min) (cm/h) de proteína de IgG ( mg IgG |
|
en el suero pico ml
suero) |
|
(mg/ml) (mg/ml)
|
|
|
|
1 8 2,3 43,9 71,18 0,674 0,107 |
|
|
|
2 12 2,3 43,9 71,18 0,980 1,980 |
|
|
|
3 12 1,1 21,0 71,18 0,840 2,100 |
|
|
|
4 8 1,1 21,0 71,18 0,702 3,950 |
|
|
Tabla 2. Comparación de la purificación de IgG de conejo antiratón por Cromatografía de
Intercambio Iónico
y de afinidad.
|
Cromatografía Cromatografía |
|
|
|
Inter. Iónico Afinidad
|
|
|
|
Volumen de suero(ml) 8 5 |
|
Conc. proteínas
92,29 92,29 |
|
en suero (mg/ml) |
|
Conc. IgG pico 1,66 1,91 |
|
(mg/ml) |
|
Recobrado 9,38 9,58 |
|
(mg IgG/ ml suero) |
|
|
|
|
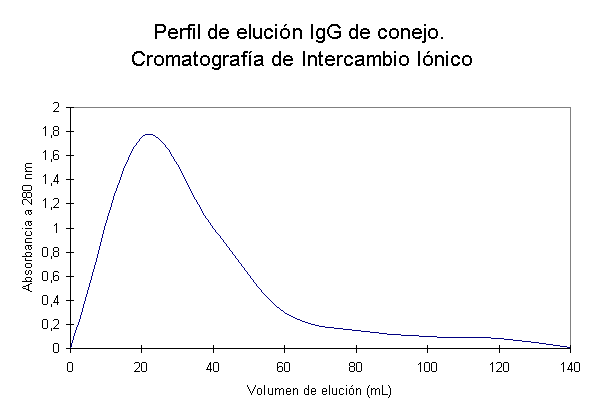
Figura 1. Gráfico de absorbancia (A) a 280 nm contra número de tubos obtenido para la purificación de IgG
de suero de conejo
por cromatografía de intercambio iónico
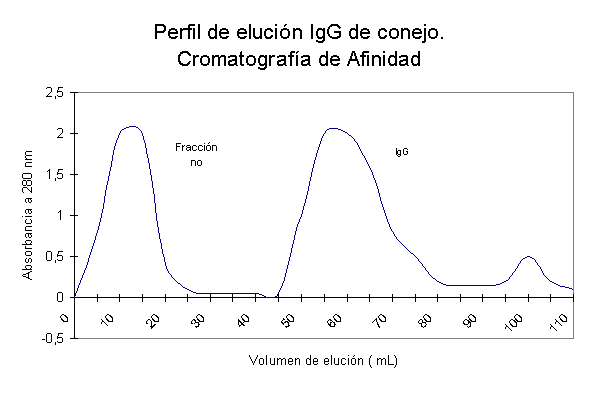
Figura 2. Gráfico de absorbancia (A) a 280 nm contra número de tubos obtenido para la purificación
de IgG de suero de conejo por cromatografía de afinidad.
DISCUSIÓN
Al analizar los resultados obtenidos en los experimentos de purificación de IgG de conejo por cromatografía de intercambio iónico, se pudo comprobar que los mejores resultados en cuanto a recobrado y pureza se obtienen en el experimento 4 que se realizó para una columna de 40 g de DEAE-Celulosa DE-52 (Wahtman) a la de velocidad de flujo de 1,1 ml/min (21 cm/h) y 8 ml de suero.
Esto se atribuye a que a bajas velocidades de flujo se logra mejor interacción
de las sustancias a separar con el gel. El empleo de menor cantidad de suero
impide que se saturen los centros activos de las resinas de intercambio
iónico lo que contribuye a lograr una mayor pureza de la IgG
separada.
Los valores de
recobrado y la pureza obtenidas para la Cromatografía de Intercambio Iónico
en DEAE-Celulosa y de afinidad en proteína A- Sepharosa
son similares en las condiciones utilizadas en el presente trabajo.
Debido al costo
tan elevado de la matriz de Proteína A- Sepharosa
y los resultados obtenidos para la purificación de IgG
de conejo por cromatografía de intercambio iónico, resulta este último el
método recomendado en nuestras condiciones de trabajo para la purificación
habitual de los antisueros.