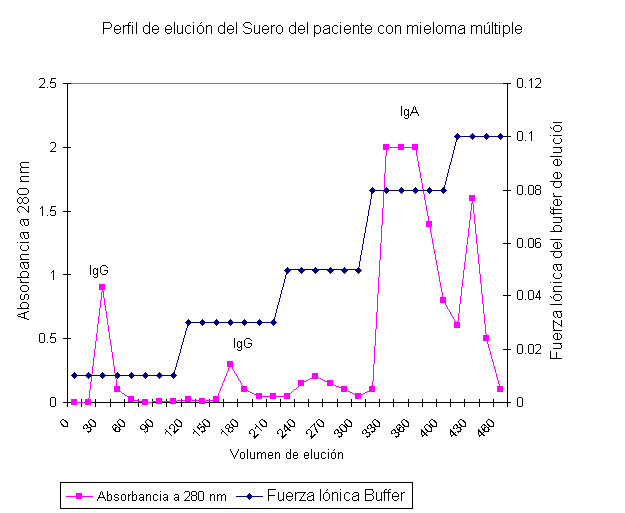
Figura 1. Perfil de elución obtenido para la purificación de IgA a partir de suero de un paciente con mieloma múltiple.
1 Esp. de 1er grado en Bioquímica. Asistente.
2 Master en Didáctica. Asistente. Instituto Superior Pedagógico "José de la Luz y Caballero" La
utilización de sueros de pacientes con diferentes patologías, ha sido una
fuente adecuada para la purificación de algunas inmunoglobulinas como la IgA y la IgM que se encuentran en
bajas concentraciones en el suero humano normal. En el presente trabajo se
realiza la purificación de IgA a partir de suero
de un paciente con mieloma múltiple. El procedimiento combina la precipitación
con sulfato de amonio al 50 % de saturación y la cromatografía de intercambio
iónico en DEAE-Celulosa DE-52. Se utilizó para la aplicación a la columna,
buffer fosfato 0,01 mol/l pH=
8 y se eluyó con gradiente discontinuo desde 0,01
mol/l hasta 0,1 mol/l del mismo
buffer.
Descriptores: Mieloma múltiple, IgA, Aislamiento y Purificación, Cromatografía.
Pathologic serums have
been used to purify different immunoglobulins like
IgA and IgM. In this paper, the
purification of IgA from multiple myeloma
serum have been made. The procedure used was carried
out by means of ammonium sulfate precipitation and ion exchange chromatography
with DEAE-Cellulose. Application step was developed with 0.01 mol/L pH=8 phosphate
buffer. Ionic gradient from 0.01 to 0.1 mol/L of phosphate buffer was
used for the elution step. The IgA eluted between
0.08 and 0.1 mol/L phosphate buffer. These results were different to be reported
for ht purification of IgA from normal human serum.
Key words:
IgA, purification, ion exchange chromatography, myeloma multiple.
La detección de numerosas patologías mediante
el uso de técnicas inmunológicas e inmunoquímicas
ha alcanzado un gran desarrollo durante los últimos años. Estas técnicas por
lo general requieren en su mayoría de la utilización de sueros hiperinmunes
anti- inmunoglobulinas humanas. Para la inmunización
y obtención de estos antisueros es de vital importancia
contar con las inmunoglobulinas en estado puro.
Entre
los métodos más utilizados para la purificación de estos anticuerpos se encuentra
la cromatografía de afinidad (1) y de intercambio iónico (2),
aunque es importante señalar que con la combinación de dos o más de estos
métodos se logran mejores resultados(3,4,5,6).
La utilización de sueros de pacientes con
determinadas patologías y a leche han resultado ser fuentes adecuadas para
el aislamiento y purificación de estas proteínas(7,.8)., siendo un ejemplo de ello el suero de pacientes con mieloma
múltiple, una ganmapatía monoclonal que produce
la proliferación neoplásica de un sólo clono de células plasmáticas, que elaboran
cantidades anormales de un tipo homogéneo de inmunoglobulinas, las IgA
acompañado de una disminución del resto (9,10).
El presente
trabajo se dirigió a la purificación
de IgA a partir de suero de un paciente con mieloma
múltiple, utilizando la combinación de la precipitación salina y la cromatografía
de intercambio iónico.
Como
material de trabajo se utilizó suero de un paciente con mieloma múltiple proveniente
de la provincia de Las Tunas. Se desarrolló un procedimiento que combina la
precipitación salina con sulfato de amonio al 50 % de saturación, posterior
desalinización del precipitado mediante diálisis y cromatografía de intercambio
iónico en DEAE-Celulosa DE-52 (Wahtman).
Para
la diálisis del precipitado y posterior aplicación a la columna, se utilizó
buffer fosfato 0,01 mol/l pH
= 8,0. La columna se eluyó con un gradiente discontinuo
de buffer fosfato desde 0,01 hasta 0,1 mol/l. Se
midió la absorbancia a 280 nm de las fracciones
colectadas para la elaboración de los cromatogramas.
Se
realizaron dos corridas con las siguientes condiciones: volumen de 8 ml de suero y una velocidad de flujo lineal de 19,10 cm/h. Se realizó inmunodifusión
a todos los picos para determinar la presencia de IgA
e inmunoelectroforesis como criterio de pureza (9).
RESULTADOS
En
las corridas se obtuvieron cromatogramas similares
como el que se muestra (figura 1). Se puede apreciar la salida de 5 picos
que eluyeron a diferente fuerza iónica.
La
primera fracción que eluye con el buffer de aplicación
se comprobó que contenía IgG. El segundo pico eluye
con el buffer fosfato 0,03 mol/l y también contiene IgG. El
tercero no contiene a ninguna de las tres inmunoglobulinas buscadas (IgG, IgA, e IgM). Con los buffer 0,08
y 0,1 mol/l pH = 8 se
obtienen dos fracciones proteicas de altos valores de absorbancia comprobándose
que ambas contenían IgA.
Se realizó la inmunoelectroforesis
a ambos picos observándose una sola banda de precipitación hacia la zona del
ánodo lo que difiere también de lo reportado por otros autores (10).
Por turbidimetría
se corroboró la presencia de altos valores de IgA
en el mismo y no se pudo detectar presencia de otras inmunoglobulinas.
DISCUSIÓN
La baja concentración de IgA en el suero humano normal ha motivado la búsqueda de fuentes
alternativas para el aislamiento y purificación de esta inmunoglobulina. En
el presente trabajo se logró la purificación de IgA a partir del suero de un paciente con mieloma múltiple.
La
elución de la IgA de la
columna de DEAE-Celulosa se logró con un gradiente de fuerza iónica de buffer
fosfato entre 0,08 - 0.1 mol/l pH = 8 .
Estos resultados difieren de lo reportado por Margni
(9) que plantea la elución de la IgA del suero normal
con buffer fosfato 0,03 mol/l pH= 8 así como menor migración en la inmunoelectroforesis.
Como
explicación a estos dos fenómenos se puede plantear la eventual modificación
de las propiedades eléctricas de la IgA en este
paciente(9), lo que influye en los resultados
de la inmunoelectroforesis y de la cromatografía
de intercambio iónico. Resultados similares se obtuvieron por otros autores
al estudiar las IgA de pacientes nefróticos(7).
La
utilización del suero de un paciente con mieloma múltiple resultó adecuada
para la purificación de IgA con alto grado de pureza
y elevada concentración, empleando la combinación de la precipitación con
sulfato de amonio al 50 % de saturación y la cromatografía de intercambio
iónico en DEAE- Celulosa mediante el
procedimiento descrito en el trabajo.
BIBLIOGRAFÍA

Figura 1. Perfil de elución obtenido para la purificación de IgA a partir de suero de un paciente con mieloma múltiple.