Indice
Anterior Siguiente
Correo Científico Médico de Holguín 2003;7(1)
Facultad de Ciencias Médicas “Mariana Grajales” Holguín
Optimización de la purificación de IgG humana por
cromatografía de intercambio iónico.
Optimization of human IgG purification by ion exchange chromatography
Tamahara Fernández
Iglesias 1, Maritza Ulloa
Román 2, Rolando Sánchez Artigas3, Elizabeth Guilarte Barinaga 4
1 Máster en Didáctica de la Química. Asistente. Instituto Superior
Pedagógico "José de la Luz y Caballero".
2
Máster en Biotecnología. Profesora Auxiliar. Instituto
Superior Pedagógico "José de la Luz y Caballero".
3 Especialista de 2do grado en
Inmunología. Facultad de Ciencias Médicas "Mariana Grajales".
4 Lic. en
Química. Facultad de Ciencias Médicas "Mariana Grajales".
RESUMEN
La purificación
de inmunoglobulinas humanas constituye el paso inicial para obtención de antisueros de gran utilidad en el diagnóstico de diferentes
patologías. En el presente trabajo se desarrolló un experimento con diseño
factorial 2En para la optimización de un procedimiento para la purificación
de IgG a partir de suero humano normal. El mismo
combina la precipitación con sulfato de amonio al 50% de saturación y la cromatografía
de intercambio iónico en una columna de 40 g de DEAE-Celulosa. Se realizaron
cuatro experimentos con el objetivo de optimizar la velocidad de flujo y el
volumen de suero. Como resultado quedaron seleccionadas como las mejores condiciones
de nuestro experimento para la purificación de IgG
por su recobrado y pureza la velocidad de 19,1 cm/h
y 8 ml de volumen de suero.
Descriptores: Inmunoglobulinas humanas.
IgG, Aislamiento y Purificación, Cromatografía.
ABSTRACTS
Purification of human immunoglobulins
like IgG is the first step in antiserum production
for clinical use. In this paper, a factorial experiment was developed for
the optimization of IgG purification from normal human serum . The procedure
used was carried out by means of ammonium sulfate precipitation and ion exchange
chromatography using 40 g of DEAE-Cellulose. Flow rate and serum volume
were analyzed through out four experiments. Application and elution steps
was developed
with 0.01 mol/L pH=8 phosphate buffer.
Flow rate of 19.1 cm/h and serum 8 ml were selected as the best conditions
for the human IgG purification in these experiments.
Key words: IgG, purification, ion exchange chromatography, optimization.
INTRODUCCIÓN
Uno de los principales retos a las Ciencias
Médicas modernas es la incorporación de los métodos inmunológicos e inmunoquímicos en el diagnóstico y la terapéutica clínica.
El desarrollo alcanzado en estos últimos años ha permitido detectar modificaciones
en los valores de las inmunoglobulinas en numerosas patologías (1).
Estas técnicas requieren por lo general de la utilización de sueros hiperinmunes de antiinmunoglobulinas
humanas para cuya obtención se necesita contar con las diferentes inmunoglobulinas
en estado puro. Entre los métodos cromatográficos
más empleados para la purificación de inmunoglobulinas se encuentra la cromatografía
de intercambio iónico (2,3,4), la de afinidad
(5,6) y la de adsorción (7,8). Por lo general se logran
mejores resultados cuando se combinan diferentes métodos(9,10,11).
El presente trabajo aborda el montaje y
optimización de un procedimiento para la purificación de inmunoglobulina G
a partir de suero humano normal.
MATERIALES Y MÉTODOS
Para la realización del presente trabajo
se utilizó un pool de suero humano proveniente del Banco Provincial de Sangre
de Holguín, debidamente certificado. Se utilizó un esquema de purificación
que combina la precipitación con sulfato de amonio al 50% de saturación, posterior
desalinización del precipitado mediante diálisis y cromatografía de intercambio
iónico en una columna que contenía 40 g de DEAE-Celulosa DE-52 (Whatman)
utilizando buffer fosfato 0,01 mol/L pH=8 para la aplicación y
la elución. A las fracciones eluidas se les midió la absorbancia a 280 nm para obtener los cromatogramas.
Para la optimización del procedimiento se
realizó un experimento con un diseño factorial 2n con el objetivo de
optimizar la velocidad
de flujo y
el volumen de
suero. Se realizaron
cuatro experimentos para los que se seleccionaron los valores máximos
y mínimos de cada variable y cuyo orden de realización se determinó aleatoriamente (12). La tabla 1 muestra los datos
para la realización de los experimentos. Se llevó a cabo la cuantificación
de proteínas por el método de Lowry (13)
y como criterio de pureza se utilizó la inmunoelectroforesis.
(2)
RESULTADOS
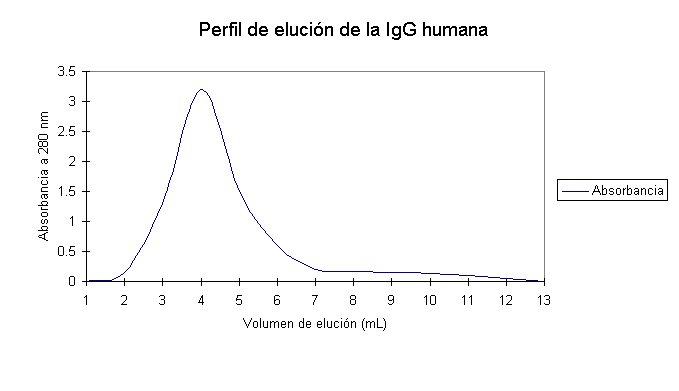
La figura 1 muestra el cromatograma típico obtenido para los diferentes experimentos. Las principales diferencias radicaron
en la altura de los picos cuya elución se realizó
con el buffer fosfato 0,01 mol/l. En aquellas corridas
que se efectuaron a alta velocidad se obtienen valores más altos de absorbancia para este pico con relación a las que se efectuaron a velocidad
más baja.
Al realizar
la doble inmunodifusión a las fracciones proteicas
colectadas con ese buffer se comprobó
que los mismos contenían IgG. De igual forma se
detectó que en el pico que eluye con buffer fosfato
0,03 mol/l hay presentes IgG e IgA.
Se realizó la
inmunoelectroforesis para comprobar el grado de pureza de
la IgG del pico 1, detectándose que sólo en las corridas 3 y 4, que se hicieron
a baja velocidad, se obtuvo la IgG pura.
En
la tabla 2 se reportan comparativamente los resultados de los experimentos
realizados. Como se puede apreciar los máximos recobrados se alcanzan cuando
los volúmenes de muestra son de 8 ml (corridas 2
y 3). Por otra parte la máxima pureza del pico IgG
se logra en aquellas corridas que se efectúan a baja velocidad de flujo (corridas 3 y 4).
DISCUSIÓN
Al analizar los resultados del cromatograma obtenido, se puede observar que este resultado
coincide con lo descrito anteriormente por Margni
(2) quien plantea que la IgG de suero humano normal, eluye
con buffer fosfato 0,01 mol/l.
El
estudio realizado de las diferentes velocidades de corrida nos muestra que
los mejores resultados se alcanzan en las que se realizan a baja velocidad,
lo que evidencia que al aumentar la misma, se produce una pobre interacción
con el gel de las sustancias a separar y ocasiona la elución con el buffer inicial de otras proteínas no deseadas.
En el experimento 3 coinciden
los mejores resultados de recobrado y pureza.
De acuerdo con los resultados de los experimentos
realizados se puede seleccionar como mejor corrida para una columna que contiene
40 g de DEAE- celulosa DE- 52, la que se efectúa a baja velocidad de flujo
(19,1 cm/h) y volumen mínimo de muestra (8 ml),
ya que en la misma se obtienen los mejores resultados de pureza y recobrado.
Por lo anterior se sugiere que se utilicen estas condiciones de corrida en
el procedimiento habitual de purificación de IgG por cromatografía de intercambio iónico a partir
de suero humano normal.
BIBLIOGRÁFICAS