Trabajo original
Facultad de Ciencias Médicas “Mariana Grajales Coello”, Departamento de Ciencias Fisiológicas, Holguín.
El Potencial Reductor Férrico (FRP). Un ensayo para evaluar la capacidad antioxidante en suero.
The Ferric Reducing Power (FRP). An assay for the serum antioxidant capacity assessment.
Pablo Bahr Valcárcel1, Yoel Basulto Lemus2.
1 Master en Bioquímica Clínica, Asistente del Departamento de Ciencias Fisiológicas, FCMH.
2 Master en Educación, Instructor del Departamento de Ciencias Naturales, ISPH.
RESUMEN
El estrés oxidativo acompaña a numerosas patologías del organismo como causa o consecuencia, por lo que puede resultar de importancia la evaluación del estado de las defensas antioxidantes en ellas. En el presente trabajo se propone un procedimiento colorimétrico sencillo y al alcance de cualquier laboratorio clínico, que permite evaluar de forma total el potencial reductor atribuible a las especies antioxidantes presentes en suero o plasma, basado en la determinación de la concentración final de los iones Fe2+ (ferrosos), formados por reducción de iones Fe3+ (férricos), utilizando ferricianuro de potasio como sustancia cromógena.
Palabras clave: estrés oxidativo, antioxidantes, capacidad, antioxidante, potencial reductor sérico.
ABSTRACT
Oxidative stress is present in different human pathologies, in which the assessment of antioxidant defences could be important. In this paper a simple, colorimetric method is described for the evaluation of the total reducing power attributable to antioxidant species which are present in serum and plasma, through the final concentration of the Fe2+ (ferrous) ions formed from Fe3+ (ferric) reduction, using potassium ferricianide as chromogen.
Key words: oxidative stress, antioxidants, antioxidant capacity, serum reducing power.
INTRODUCCIÓN
El estrés oxidativo es un término empleado para denotar un desbalance entre la producción de especies químicas oxidantes y los sistemas de defensa antioxidantes del organismo.(1) Los oxidantes incluyen, especies reactivas de oxígeno, de nitrógeno y radicales de azufre, entre otros, y aunque no todos son radicales libres, su peligro radica en que los productos de oxidación, formados en las reacciones donde ellos intervienen, son a su vez nuevos radicales con potencialidad para propagar la reacción que conduce a un daño más extenso (2). La formación de estas especies puede ser generada por numerosos procesos tales como radiaciones ionizantes, reacciones enzimáticas y reacciones químicas redox catalizadas por iones metálicos de transición libres o enlazados a otras enzimas. Otras fuentes celulares son la reducción incompleta del oxígeno durante el funcionamiento de la cadena respiratoria mitocondrial y el mismo sistema defensivo celular en el organismo, mediado por la generación de compuestos oxidantes como el ácido hipocloroso y los radicales superóxidos.
Usualmente estas especies reactivas son eliminadas “in vivo” por un conjunto de antioxidantes, entre los que se incluyen enzimas especializadas y compuestos químicos, que se despliegan con el objetivo de prevenir, destruir o inactivarlas, de forma que el daño es mínimo si los componentes del sistema defensivo antioxidante se encuentran en adecuadas cantidades y actividades biológicos (3). Sin embargo, una deficiencia absoluta o relativa de las defensas antioxidantes puede conducir a una situación de estrés oxidativo incrementada, que se ha podido asociar con las causas o consecuencias de una gran variedad de patologías, incluyendo enfermedades cardiovasculares, neurodegenerativas, diabetes, cáncer y muchas otras (4-11).
Las pruebas que miden el efecto combinado de las defensas antioxidantes no enzimáticas en los fluidos biológicos son útiles, al proveer de índices de la capacidad para resistir el daño oxidativo, aunque muchas de ellas requieren de reactivos específicos y equipamiento técnico que limitan la disponibilidad de las mismas. Por estas razones, un procedimiento que emplee una reacción redox colorimétrica con un exceso de un compuesto fácilmente oxidable podría ofrecer una manera simple de evaluar las potencialidades reductoras de las defensas antioxidantes no enzimáticas en estos fluidos.
Benzie y colaboradores (12) propusieron en 1996 un método que mide la potencialidad plasmática de reducir iones férricos (Ferric Reducing Ability of Plasma, FRAP) utilizando como agente cromógeno 2,4,6-tripiridil-S-triazina, el cual se ha ido extendiendo por la facilidad en la obtención de los resultados, y se ha aplicado incluso a otros muchos tipos de muestras biológicas, aunque la asequibilidad del reactivo cromógeno puede limitar su utilización. En el presente trabajo se propone una modificación de este ensayo FRAP, que sustituye este agente cromógeno por uno de más fácil acceso para su empleo en cualquier laboratorio clínico, con el fin de evaluar el potencial antioxidante total en suero o plasma.
MÉTODO
Reactivos.
Se emplean como reactivos: solución de ácido tricloroacético (TCA) al 10%; solución patrón de FeSO4.7H2O 1000 mmol/L; solución tampón de acetato 300 mmol/L de pH 3,6; solución de FeCl3.6H2O 20 mmol/L y solución de K3Fe(CN)6 0,3 mmol/L.
Para su empleo durante el ensayo, se prepara una solución de trabajo (solución FRP) mezclando 1,5 ml de solución de FeCl3 y 1,0 ml de solución de K3Fe(CN)6 con 15 ml de tampón acetato pH 3,6 precalentado previamente a 37°C.
Muestras y patrones.
Las muestras de suero en ensayo deben ser previamente desproteinizadas con igual volumen de TCA 10%, luego centrifugadas y el sobrenadante claro se utiliza como muestra para la realización del ensayo. A los patrones de distintas concentraciones, preparados a partir de la solución madre (250, 500 y 1000 mmol/L), se les adiciona igual volumen de TCA 10% para compensar el efecto de dilución y acidez provocado por la desproteinización de las muestras.
Antioxidantes.
Se ensayaron soluciones de Ácido Ascórbico, Acido Urico y Albúmina Sérica Humana de distintas concentraciones dentro del rango normal en el suero humano, para el estudio de la contribución de cada una al potencial reductor.
Ensayo FRP.
En una placa de 96 pozos se depositan 50 mL de agua (Blanco), de solución patrón de FeSO4 de diferentes concentraciones (Patrones) y del sobrenadante desproteinizado de las muestras en ensayo (Muestras). Posteriormente se añaden 100 mL la de solución de trabajo FRP en cada pozo y se deja en reposo durante 60 minutos a temperatura ambiente. La Absorbancia de los pozos se mide contra el blanco, a 720 nm. El Poder Reductor Férrico se expresa para cada muestra como la cantidad de Fe que aparece reducido ( en mmol de Fe2+/L ), empleando los datos de los patrones para su determinación.
RESULTADOS
Inicialmente fueron estudiadas las tasas de incremento en el transcurso del tiempo de la Absorbancia medida a 720 nm para soluciones patrones de Fe2+, para las soluciones de antioxidantes ensayados y para muestras de suero humano de individuos supuestamente sanos empleando el procedimiento FRP descrito. La figura 1 muestra las variaciones observadas para las lecturas del blanco y la solución patrón de 500 mmol/L. El bajo registro de la Absorbancia del blanco se mantiene con buena estabilidad durante el tiempo ensayado. En los valores medidos de la solución patrón se aprecia que se alcanza un valor máximo al cabo de 10 minutos de iniciada la reacción, que luego se mantiene estable en el rango de tiempo ensayado.
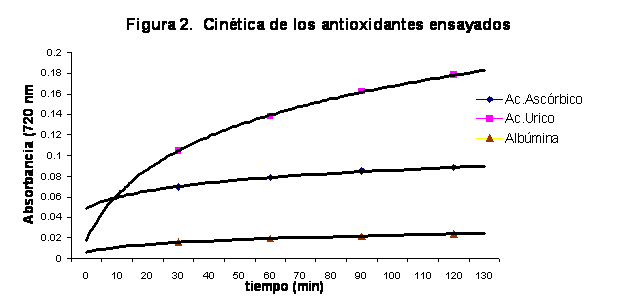
En la figura 2 se muestran los valores del experimento realizado para evaluar la cinética de reacción de varios antioxidantes normalmente presentes en el plasma, tales como la Albúmina, Acido Ascórbico y Acido Urico. Se evidencia un gradual ascenso de la Absorbancia, que resulta mucho más discreto a partir de los 60 minutos de reacción. Además, cada antioxidante muestra diferente actividad, siendo la mayor para el Acido Urico mientras que la Albúmina exhibe una baja actividad antioxidante evaluada por este ensayo.
En la figura 3 se reflejan los resultados de la variación de la Absorbancia durante el transcurso del tiempo en algunas muestras de suero humano de individuos sanos. Se observa igualmente un gradual incremento durante los primeros 60 minutos de reacción, alcanzándose luego una buena estabilidad en las lecturas.
Fue escogido como tiempo de reacción 60 minutos, y se estudió la respuesta del ensayo a diferentes concentraciones de iones Fe2+ aportados directamente por soluciones de FeSO4.7H2O, o por la actividad reductora de las soluciones de antioxidantes empleados. La figura 4 muestra una curva patrón típica registrada con soluciones de Fe2+ de concentraciones crecientes (250, 500 y 1000 mmol/L) donde se observa una respuesta lineal, y a la que corresponde un coeficiente de correlación de 99,78%.
En la figura 5 se reflejan los resultados de un experimento dosis-respuesta para los distintos antioxidantes ensayados. Puede apreciarse que también los valores de Absorbancia obtenidos guardan una relación lineal con las concentraciones de cada antioxidante respectivo. Se comprueba además que la actividad del Ácido Úrico como agente reductor en el plasma es mayor que la del Ácido Ascórbico.
Finalmente, con el objetivo de evaluar las posibles interacciones y efectos sinérgicos entre los antioxidantes usados se prepararon diferentes mezclas de Ácido Ascórbico y Ácido Úrico con concentraciones distintas de cada uno de estos reactivos, y los valores experimentales obtenidos de su actividad reductora se correlacionaron con los predichos a partir de los datos recogidos de cada uno en forma separada. La figura 6 refleja los resultados del experimento con una buena regresión lineal, y un valor de R2 de 0,82.
.gif)
.gif)
.gif)
.gif)
.gif)
DISCUSIÓN
El ensayo propuesto es económico y sencillo de ejecutar, y los reactivos empleados están al alcance de cualquier laboratorio clínico, sin grandes exigencias de su instrumental. En nuestro caso se adaptó como una microtécnica a una placa de 96 pozos y las lecturas se realizaron en un equipo Multiskan con un filtro de 720 nm, pero puede fácilmente ejecutarse con cualquier fotocolorímetro de trabajo si se emplean cantidades mayores de sustancias.
La estabilidad mostrada por las lecturas del Blanco preparado (figura 1) indica que no se verifican reducciones espontáneas de Fe3+ a ese valor de pH escogido durante el tiempo de reacción, por lo que la aparición del color en el caso de las muestras puede asociarse sólo a la actividad antioxidante de los componentes presentes en ellas. Igualmente se pudo constatar que la presencia de iones Fe2+ libres en plasma no es detectable por este ensayo, por lo que su aparición en el medio es debida sólo a la reducción provocada de los iones Fe3+ aportados por el reactivo de FeCl3.
Es importante reconocer que aunque pueden ser varios los compuestos con propiedades antioxidantes presentes en las muestras, cada uno exhibe su actividad y características cinéticas propias. En nuestros experimentos se destacan el Ácido Ascórbico por su rapidez en la reacción, y el Ácido Úrico por su considerable aporte particular al Potencial Reductor Férrico, aunque la velocidad de reacción de este último es menor. Los hallazgos descritos por Benzie (1996) en cuanto a las características cinéticas de las reacciones del Ácido Ascórbico y el Ácido Úrico con iones Fe3+ son similares a los nuestros, y aunque evalúa la actividad de ambos en un nivel semejante, la diferente concentración de estos compuestos en el plasma humano normal le permitió calcular un aporte de 15 y 60% respectivamente al Potencial Reductor Férrico total del plasma.
Las características cinéticas individuales de los antioxidantes ensayados en nuestro trabajo demostró la utilidad de emplear un tiempo de reacción de 60 minutos, que permite evidenciar plenamente el aporte de cada componente al Potencial Reductor Férrico total. Este tiempo se utilizó para la evaluación de este potencial en cuatro muestras de suero humano de individuos supuestamente sanos (figura 3) y los resultados obtenidos se correspondieron con los reportados en la literatura para los valores normales (600 – 1200 mmol/L).
Un compuesto de interés es la Albúmina plasmática, cuya función en las defensas antioxidantes se ha atribuido fundamentalmente a su papel como escudo o pantalla de protección pasiva de otras biomoléculas, oxidándose con preferencia a ellas por estar en mayor concentración. Eso explicaría el bajo aporte apreciado de esta proteína plasmática al Potencial Reductor total. En nuestro trabajo pudimos comprobar que la presencia de proteínas aportadas por las muestras en el medio de reacción aumenta significativamente el tiempo necesario para alcanzar lecturas estables y útiles, por lo que decidimos introducir un paso previo de desproteinización de las muestras, utilizando una solución de Acido Tricloroacético al 10%. Con esta variación la velocidad de reacción alcanzada permite limitar el tiempo de espera a 60 minutos antes de realizar las lecturas de Absorbancia, aunque excluya el aporte de la Albúmina en el Potencial, que ya comprobamos que no es muy alto.
Benzie y colaboradores (1996) en su trabajo de referencia reconocen la baja contribución de la Albúmina en su ensayo, atribuyéndolo al efecto del bajo valor de pH del medio (tampón Acetato pH 3,6) sobre los grupos tioles oxidables de los restos de aminoácido Cisteína en la proteína. En su ensayo FRAP no se incluye desproteinización, y se limita el tiempo de reacción a 10 minutos, pero se reconoce que algunos antioxidantes siguen aumentando sus contribuciones a las lecturas de Absorbancia en el transcurso del tiempo.
Otra característica de importancia es la linealidad exhibida en la relación entre la Absorbancia registrada y la concentración del compuesto coloreado, formado entre el reactivo de ferricianuro y los iones ferrosos (Fe2+) presentes en la solución. Como muestra la figura 4, en el caso de soluciones patrones de concentraciones crecientes de iones Fe2+ la correlación alcanzó coeficientes mayores del 99%. Asimismo la presencia en el medio de reacción de sustancias con actividad antioxidante como el Ácido Úrico, Ácido Ascórbico y Albúmina provoca la reducción de los iones férricos (Fe3+) aportados por el reactivo de FeCl3 en una cantidad proporcional a la concentración inicial de los antioxidantes (figura 5), lo que indica la posibilidad de utilizar el ensayo como medida completa del aporte de cada uno de los compuestos antioxidantes presentes en las muestras en estudio. Los resultados del experimento diseñado para comprobar los posibles efectos cooperativos entre los distintos antioxidantes muestran una total independencia de la contribución de los mismos al Potencial Reductor Férrico del plasma, evaluada por la alta correlación entre los valores predichos y evaluados experimentalmente de mezclas de distintas concentraciones de los antioxidantes utilizados en el ensayo (figura 6).
Un aspecto relevante del ensayo FRP descrito en este trabajo es su reproducibilidad, que mostró valores de coeficientes de variación intraserie e interserie menores de 3 y 6% respectivamente.
El procedimiento diseñado y evaluado en nuestro laboratorio para la determinación del Potencial Reductor Férrico (FRP) en muestras de plasma o suero, también lo hemos empleado en otras muestras biológicas tales como decocciones de plantas, extractos vegetales, bebidas alcohólicas y no alcohólicas(13). En estos casos no es necesario realizar el paso inicial de desproteinización, pero sí se ha mantenido en 60 minutos el tiempo de reacción considerando que los polifenoles, muy abundantes y de alta contribución al Potencial Reductor Férrico en vegetales, muestran una cinética de reacción lenta, similar a la observada para el Ácido Úrico. Potencialmente podría también emplearse la técnica en la evaluación de las propiedades reductoras de fármacos y suplementos dietéticos, con relativa facilidad.
Las condiciones de reacción utilizadas en este ensayo están bastante alejadas de las fisiológicas, por lo que los resultados observados muy probablemente no reflejen la jerarquía real de actividades y características cinéticas de los antioxidantes presentes en la muestra. No obstante, consideramos que el ensayo FRP utiliza reactivos económicos y de sencilla preparación, con resultados altamente reproducibles, y ofrece, por tanto, una posibilidad más de evaluar el potencial reductor de muestras biológicas con una tecnología al alcance de cualquier laboratorio clínico.
BIBLIOGRAFÍA