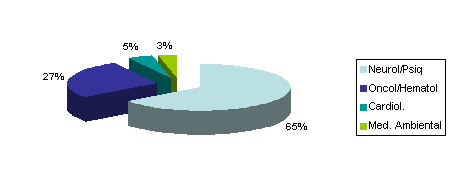Indice
Anterior
Siguiente
Correo Científico Médico de Holguín 2003;7(3)
Trabajo de revisión
Departamento de Genética Molecular,
Centro para la Investigación y Rehabilitación
de las Ataxias Hereditarias “Carlos J. Finlay”. Holguín.
La farmacogenómica: un
acercamiento a una medicina personalizada.
Pharmacogenomics: an approach to a personalized medicine.
Luis Enrique Almaguer
Mederos1, Yobanis Rodríguez Almira2, Yanetza González
Zaldivar3, José Laffita Mesa4.
1, 2
Lic. Biología.
3, 4
Lic. Microbiología.
RESUMEN
La aplicación
de las nuevas tecnologías de la genómica a la farmacéutica ha posibilitado
el surgimiento de la farmacogenómica, una disciplina de gran alcance que propone
el estudio de las diferencias genéticamente determinadas entre individuos
en la respuesta a fármacos. La identificación de numerosos polimorfismos genéticos
en componentes claves para la recepción, transporte y metabolismo de medicamentos,
ha sugerido una vía para la optimización de la terapia farmacológica, y ha revelado la existencia de importantes diferencias
poblacionales en la frecuencia de estos polimorfismos. La farmacogenómica
ha tenido el mayor impacto en la neuropsiquiatría, y se espera que contribuya
significativamente a mejorar la efectividad, y seguridad del tratamiento medicamentoso.
Palabras clave: farmacogenómica, polimorfismo genético, terapia farmacológica, neuropsiquiatría.
ABSTRACT
The application of the new technologies of genomics
to the pharmacist has facilitated the emergence of farmacogenomics,
a discipline that proposes the study of the differences genetically certain
among individuals in drugs response. The identification of numerous genetic
polymorphisms in key components for the reception, transport and drugs metabolism,
has suggested a road for optimization of the pharmacological therapy, and
it has revealed the existence of important population differences in the frequency
of these polymorphisms. Farmacogenomics has had
the biggest impact in the neuropsychiatry´s field,
and it is expected that it contributes significantly to improve the effectiveness,
and security of drugs therapy.
Key words: farmacogenomics,
genetic polymorphisms, drugs therapy, neuropsychiatry.
INTRODUCCIÓN
El siglo 20 ha
sido prolífico en el desarrollo de un amplio arsenal de terapias contra un
gran número de enfermedades infecciosas, cardiovasculares, neoplásicas y psiquiátricas.
Sin embargo, en numerosas ocasiones la terapia farmacológica ha fallado en
su propósito terapéutico e incluso, ha provocado la aparición de efectos secundarios
lesivos. De hecho, en 1973 fue reportado que el 28% de una serie de pacientes
hospitalizados tuvieron reacciones adversas ante determinados medicamentos1. Más recientemente fueron reportadas 2 216 000 reacciones adversas
serias a medicamentos en pacientes hospitalizados2, y en 1995 fue estimada
en 76,6 billones la mortalidad/morbilidad debida al consumo de medicamentos3.
Aún a principios
del Tercer Milenio, la medicina dirige la terapia farmacológica hacia los
amplios sectores poblacionales que “probablemente” resulten beneficiados de
esta. El procedimiento general se basa en el análisis estadístico de la respuesta
de la población para predecir el resultado terapéutico en pacientes individuales.
Sin embargo, el uso universal de determinados fármacos ha revelado la existencia
de notables diferencias interindividuales y poblacionales en la respuesta
a estos. El reconocimiento de estas diferencias constituye un paso esencial
en el proceso de optimización de terapias, y en las últimas décadas se ha
recogido evidencia abrumadora de que una porción sustancial de la variabilidad
observada en la reacción a medicamentos está genéticamente determinada4. Estas observaciones han propiciado el surgimiento y desarrollo de
nuevas disciplinas científicas dirigidas a elucidar los fundamentos genéticos
de las diferencias interindividuales y poblacionales en cuanto a la respuesta
a fármacos.
Aquí nosotros
hacemos una revisión bibliográfica de los propósitos, fundamentos, beneficios
potenciales de la farmacogenómica, y discutimos brevemente su aplicación a
la neuropsiquiatría.
Farmacogenética
vs. Farmacogenómica.
Las observaciones
realizadas alrededor de 1950 acerca de la gran variabilidad interindividual
en la respuesta a fármacos, dieron origen a una nueva disciplina científica
llamada “farmacogenética”, producto de la confluencia de la genética, la bioquímica,
y la farmacología. El término fue acuñado por Vogel en 1959 para el estudio
de variaciones genéticamente determinadas en la reacción a medicamentos5.
El objeto de
estudio de la farmacogenética consiste en la determinación de cómo el genotipo
de un individuo puede afectar la respuesta de su cuerpo a determinados fármacos,
a través de la búsqueda de polimorfismos que correlacionen con cierta presentación
clínica. Es conocido que la reacción de un individuo a un medicamento determinado
depende de varios factores ambientales, fisiológicos y conductuales. Así por
ejemplo, tanto los jóvenes como los ancianos son muy susceptibles a la morfina
y sus derivados, así como muchos pacientes con enfermedad hepática. Sin embargo,
los polimorfismos genéticos en componentes claves del metabolismo de los medicamentos
constituyen uno de los elementos más importantes en la interpretación de la
variabilidad interindividual en la respuesta a la terapia farmacológica 12. En esencia, la farmacogenética
puede ser definida como el estudio de las bases hereditarias de las diferencias
inter-individual y poblacional en cuanto a la reacción a los medicamentos.
Cuando esto es aplicado a sustancias extrañas no terapéuticas o xenobióticos,
es utilizado un término equivalente: toxicogenética5, 6.
La farmacogenómica
es una disciplina más recientemente surgida, producto de la fusión entre la
farmacogenética y la genómica7. A través de técnicas
de amplio alcance en el análisis del ADN, la genómica introdujo una nueva
dimensión al desarrollo de una medicina personalizada; la estrategia tradicional
de búsqueda de polimorfismos sobre la base del estudio individual de genes
candidatos, es sustituida por el estudio simultáneo de todo el genoma 8-10.
Después de su
entrada al organismo, cada medicamento interactúa con una serie de proteínas
diferentes, entre las que pueden encontrarse transportadores, muchos tipos
de receptores y enzimas metabolizadoras11, 12. Estas proteínas
determinan la adsorción, distribución, excreción, sitio de acción y respuesta
farmacológica del medicamento. Además, estas sustancias farmacológicamente
activas desencadenan eventos secundarios que también pueden mostrar variación
entre los pacientes. Debido a la complejidad del metabolismo de los medicamentos,
la farmacogenómica constituye una estrategia que ofrece un acercamiento más
integral a los mecanismos y elementos claves de la reacción a fármacos, y
constituye un significativo paso de avance en la aproximación a la práctica
clínica del reconocimiento del perfil genético de cada individuo como determinante
de su reacción a medicamentos11-13.
En la actualidad
ya han sido identificados varios polimorfismos en proteínas, que apoyan la
significativa importancia de la constitución genética en la respuesta de los
individuos a los medicamentos, y que han permitido el desarrollo de nuevas
estrategias terapéuticas y el perfeccionamiento de otras ya existentes (Tabla
1).
Polimorfismos y poblaciones.
A sido demostrado
que las frecuencias poblacionales de muchos caracteres farmacogenéticos dependen
de la composición étnica de las mismas14.
En 1932, Sydney
demostró que la incapacidad para detectar el sabor de la feniltiocarbamida
(PTC) se heredaba como un carácter autosómico recesivo mendeliano. Esta fue
la primera demostración de que una sensación química podía ser heredada y
de que una percepción química podría servir para diferenciar individuos. A
través de estudios poblacionales ha sido encontrado que los Negros Africanos
tienen una incidencia para este carácter de aproximadamente un 6%, sin embargo,
los Negros Americanos tienen entre un 2% y un 23%, y los Blancos Americanos
aproximadamente un 30%, mientras que los chinos tiene alrededor de un 6%,
y los esquimales del este, aproximadamente un 40% 5, 14.
Anteriormente,
en 1902, Alchibald Garrod propuso que las diferencias genéticamente determinadas
en procesos bioquímicos podrían ser la causa de reacciones adversas después
de la ingestión de medicamentos. Significativamente, Garrod llegó a sugerir
que existían enzimas implicadas en la detoxificación de sustancias exógenas,
y que ese mecanismo podría fallar en aquellas personas que carecieran de la
enzima requerida. Esta hipótesis recibió mucho apoyo cuando fue descubierto
durante la Segunda Guerra Mundial, que la “hemólisis por primaquina” era mucho
más frecuente en soldados africano-americanos del ejército norteamericano
que tomaban la primaquina como antimalárico. Estudios posteriores realizados
en el período de post-guerra demostraron que la causa de esta hemólisis inducida
por un fármaco estaba en una deficiencia genética de la glucosa-6-fosfato
deshidrogenasa (G-6-PD). Este carácter se hereda como un rasgo recesivo ligado
al cromosoma X. La deficiencia de la G6PD es rara en la mayoría de los caucásicos,
pero afecta alrededor del 10% de los varones de origen afrocaribeño y es también
frecuente en varones de origen mediterráneo5, 6.
Otro sistema
farmacogenético de gran importancia es el del citocromo P450. Este sistema
de enzimas es responsable de una parte significativa del metabolismo de fármacos
en humanos. Aunque se relacionan fundamentalmente con la detoxificación de
xenobióticos, estas enzimas también son responsables de la activación de pro-mutágenos
y pro-cancerígenos. Entre los subtipos P450 más estudiados por su rol en la
reacción genéticamente determinada a un amplio espectro de fármacos, están
el CPY2D6, 2C9, 2C19, 1A2, 2E1, y el 3A4/3A5. Los polimorfismos de la CPY2D6
son clasificados en: funcionales, pobremente funcionales y no funcionales.
La frecuencia de los polimorfismos funcionales alcanza un 71% en poblaciones
caucásicas y un 50% en poblaciones de origen africano. Los pobremente funcionales
aparecen con una frecuencia de tan solo el 3% en caucásicos, del 41% en asiáticos
y del 35% en africanos. Los pacientes homocigóticos para los alelos nulos
de CPY2D6, son metabolizadores pobres de varios fármacos y son más propensos
a sufrir reacciones adversas. La frecuencia de este carácter recesivo alcanza
entre el 1% y 2% en individuos de origen asiático, aproximadamente un 5% en
afro-americanos, y entre el 6% y 26% en poblaciones caucásicas5,
14-17.
Estas observaciones
sugieren que se debe ser muy cuidadoso al hacer extrapolaciones con respecto
a los sustratos para las variantes enzimáticas, de no ser tomadas en consideración
las diferencias poblacionales en la frecuencia de caracteres farmacogenéticos.
Aplicación de la farmacogenética a la neuropsiquiatría.
A pesar de que
la farmacogenética ha sido aplicada a múltiples disciplinas de las ciencias
médicas, el área dónde más aplicación ha tenido hasta la fecha ha sido el
de la neuropsiquiatría (Gráfico 1).
Probablemente,
el mejor ejemplo de cómo la farmacogenética cambiará el futuro de la neuropsiquiatría
proviene del tratamiento a la Enfermedad de Alzheimer (EA). Esta afección
constituye la forma más común de demencia, de la cual existen dos formas fundamentales,
la familiar y la esporádica. En general, se considera que la etiología es
multifactorial, aunque ha sido bien documentada la existencia de un patrón
de herencia autosómico dominante observado en hasta un cuarto de todos los
casos con EA. Las formas esporádicas constituyen el 85% de los casos en todo
el mundo, y el 50-60% de estos casos han sido asociados con el gen de la apolipoproteína
E - esta proteína está involucrada en el transporte del colesterol y los fosfolípidos-.
Ha sido demostrado que existe una asociación clara entre el número de isoformas
ApoE4 que tiene un individuo y el desarrollo de la enfermedad, la edad de
inicio, y la acumulación de marcadores encefálicos de la EA. La presencia
de dos copias de ApoE4 está asociada a una enfermedad de Alzheimer de comienzo
hacia los 60 años, una copia produce una enfermedad de inicio hacia los 75
años, mientras que aquellos pacientes que no tienen copia de ApoE4, manifiestan
la enfermedad hacia los 85 años18-22.
El descubrimiento
de que el alelo ApoE4 está fuertemente ligado tanto a la forma esporádica
como familiar de la EA, sugiere que
alteraciones en el sistema de transporte de lípidos podría afectar seriamente
la homeostasis lipídica en el encéfalo. Esto, a su vez, podría traer como
consecuencia la alteración del sistema colinérgico, debido a que, a diferencia
de otros neurotransmisores del sistema nervioso central, la síntesis de acetilcolina
depende en gran medida de los lípidos. De hecho, ha sido demostrada la existencia de
una relación inversa entre el número de copias ApoE4 y la actividad residual
de la colina acetiltransferasa encefálica y los sitios de unión de nicotina
en encéfalos de sujetos con la EA. Además, también ha sido demostrado que
la presencia del alelo ApoE4 afecta diferencialmente la calidad y magnitud
de la respuesta a fármacos en sujetos con la EA tratados con agentes colinomiméticos
y no-colinomiméticos. En este sentido, ha sido encontrado que los individuos
no-ApoE4 responden muy bien a un fármaco llamado Tacrina™, un bloqueador
de la acetilcolinesterasa- enzima que degrada a la acetilcolina-, mientras
que los ApoE4 responden mal a este medicamento. También ha sido demostrado
que el genotipo ApoE incide en la reacción a otros fármacos, incluso con mecanismos
de acción diferentes al de la Tacrina™.
Así por ejemplo, la Xanomelina™ simplemente reemplaza la acetilcolina,
por lo que cabría esperar que funcionara en todos los casos. Sin embargo,
ha sido demostrado que los pacientes con dos copias de la ApoE3 responden
muy bien, aquellos con un alelo ApoE3 y uno ApoE4 responden mal, y los portadores
de dos alelos ApoE4 respondieron incluso peor que los que tomaron el placebo.
Como otro ejemplo cabe citar el del S-12024; este fármaco trabaja en una vía
que evita totalmente al sistema colinérgico en el encéfalo. Aun en este caso,
ha sido encontrado que personas portadoras de dos copias del alelo ApoE4 muestran
una clara mejoría, mientras que los que no portan ninguna copia del ApoE4
muestran un deterioro continuo. O sea, que los medicamentos diseñados para
actuar sobre el sistema colinérgico funcionan bien en individuos que no son
portadores del alelo ApoE4. Y además, que los medicamentos diseñados para actuar sobre
sistemas no- colinérgicos funcionan bien en individuos que son portadores
del alelo ApoE414, 23.
Avances considerables
también han sido logrados con relación a los fármacos anti-epilépticos (FAE),
antisicóticos, y al tratamiento de la esquizofrenia14, 25, 26.
Beneficios anticipados de la farmacogenética.
Se prevé que
la farmacogenética impactará significativamente sobre la asistencia médica.
Las empresas farmacéuticas podrán diseñar medicamentos basados en las proteínas,
las enzimas y las moléculas de ARN asociadas a procesos patológicos. Esto
facilitará el descubrimiento de nuevos fármacos y el desarrollo de terapias
dirigidas a enfermedades específicas, lo que no sólo maximizará el efecto
terapéutico, sino que también disminuirá el daño a células sanas cercanas
al tejido dañado por la enfermedad. Con la farmacogenética podría eliminarse
el método de prueba- error aplicado tradicionalmente para prescribir a un
paciente el medicamento apropiado. El médico podrá analizar el perfil genético
del paciente y prescribir desde el principio el mejor medicamento disponible.
Esto no sólo eliminaría el trabajo de adivinar cual sería el medicamento adecuado
en cada caso, sino que también mejoraría la velocidad de recuperación y aumentaría
la seguridad, dado que reduciría significativamente la probabilidad de reacciones
adversas. Por otra parte, los métodos tradicionales, basados en el peso y
la edad, para la determinación de la dosis adecuada, podrían ser sustituidos
por la dosificación basada en el perfil genético de la persona. Esto maximizaría
la terapia y reduciría significativamente la probabilidad de ocurrencia de
casos de sobredosis14, 27, 28.
El conocimiento
de su propio perfil genético le permitiría a la persona optar por un estilo
de vida y cambios de ambiente adecuados a temprana edad, de modo que podría
evitar o disminuir la severidad de una enfermedad genética dada. Del mismo
modo, el conocimiento del estado de riesgo para determinada afección, posibilitaría
un monitoreo cuidadoso, y podrían ser entonces introducidos tratamientos en
la etapa más apropiada para maximizar su terapia14.
La farmacogenética
también impactará significativamente la práctica médica a través del desarrollo
de mejores vacunas. Las vacunas hechas a partir de material genético, ADN
o ARN, prometen todos los beneficios de las vacunas actuales sin sus riesgos.
Estas vacunas son capaces de activar el sistema inmune pero no causan infección.
Además, serán relativamente baratas, estables, fáciles de almacenar, y susceptibles
a ser manipuladas para incorporar varias cepas de un patógeno a la vez14.
El descubrimiento
de nuevas terapéuticas potenciales será más fácil con el uso de dianas genómicas.
En el pasado reciente, muchos ensayos clínicos fallaron en demostrar la eficiencia
de determinados medicamentos, por no tomar en consideración la constitución
genética de los individuos. Por ejemplo, el hallazgo de que el alelo ApoE4
está fuertemente asociado con la enfermedad de Alzheimer constituyó un escándalo
para muchas industrias farmacéuticas, ya que siempre asumieron que cuando
los pacientes eran reclutados para un ensayo clínico, tenían las mismas características.
Sin embargo, ha sido demostrado que los individuos que carecen del alelo ApoE4
tienden a degradar de 2 a 3 veces más rápidamente que los que portan una o
dos copias del mismo. Esto significa que si les fuera dado un placebo a dos
grupos de individuos- un grupo formado exclusivamente por individuos portadores
del alelo ApoE4, y otro formado por individuos no-portadores de este alelo-
habría una diferencia estadísticamente significativa entre ambos, debido a
que la EA es una afección con dos tasas de degradación diferentes14.
Además, la disminución
en el número de reacciones adversas, de ensayos clínicos fallidos, del tiempo
requerido para la aprobación de un medicamento, del tiempo necesario de aplicación
del medicamento, del número de medicamentos que un paciente debe tomar hasta
encontrar una terapia efectiva, de los efectos de una enfermedad en el cuerpo
(a través de su detección temprana), y el incremento en el rango de posibles
dianas farmacéuticas promoverá una disminución neta en el costo de la atención
médica14.
En general, los
beneficios que la farmacogenética reportará a la atención médica pueden ser
resumidos de la siguiente manera:
1.
Medicinas más potentes.
2.
Mejores medicamentos y más efectivos desde la primera vez.
3.
Métodos más apropiados para determinar dosis apropiadas de
medicamentos.
4.
Pezquisaje avanzado de enfermedades.
5.
Mejores vacunas.
6.
Mejoramiento en el descubrimiento de medicamentos y procesos
de aprobación.
7.
Disminución en los costos de la atención médica.
El futuro cercano.
Como resultado
del desarrollo acelerado actual de la farmacogenómica, se espera que en los
próximos 5 años el diagnóstico de las enfermedades se practique cada vez con
mayor basamento en el genotipo (el mecanismo que subyace a la enfermedad)
que en el fenotipo (signos y síntomas observables), lo que permitiría la determinación
más exacta de la terapéutica adecuada en cada caso. Es muy probable que para
esa fecha estén disponibles métodos sencillos y de gran alcance que les permita
a los pacientes ser genotipados para una serie de polimorfismos farmacogenéticos.
Quizás optimistamente, también se espera que dentro de cinco años esté disponible
para uso clínico el primer test de predicción de respuesta a un cierto número
de fármacos antisicóticos (muy probablemente para las comúnmente usadas clozapina
y olanzapina) 26.
BIBLIOGRAFÍA