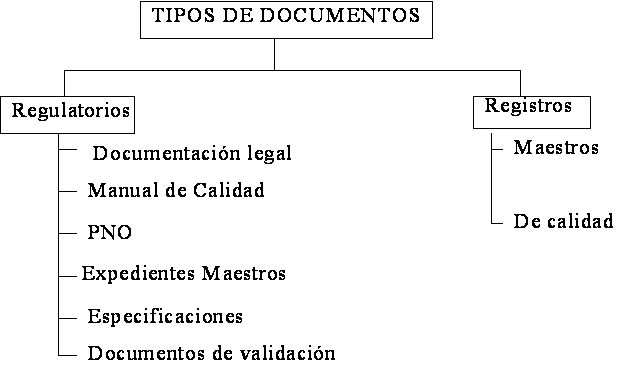
Centro de Inmunología y Biopreparados de Holguín
Implantación de un sistema documental en el Centro de Inmunología y Biopreparados .
A documental system establishment at the Inmunology and Bioprepared Products Center.
Zulem Pérez Rodríguez1
1 Máster en Ciencias. Profesor Instructor del Dpto de Ingeniería Industrial. Universidad de Holguín.
RESUMEN
Dentro del sistema de gestión de la calidad, la documentación juega un papel esencial, al permitir entre otros beneficios obtener la calidad requerida, evaluar el funcionamiento del sistema, mantener los logros obtenidos y mejorar el desempeño. Por ello se realizó este trabajo en el Centro de Inmunología y Biopreparados de Holguín, como parte del proceso de implantación de un sistema de la calidad acorde NC-COPANT-ISO 9002:94 1 y la NC 26-211: 1992 2.
Como resultados fundamentales se definieron los tipos de documentos a elaborar en el centro y su jerarquía, los principales procesos de la documentación, se confeccionaron el Manual de la Calidad, los procedimientos generales y otros documentos; y se implantó el uso de los principales procedimientos y registros del sistema de la calidad.
Palabras clave: documentación, sistema de la calidad, ISO 9000, Buenas Prácticas de Producción Farmacéutica.
ABSTRACT
Within the quality management system, documentation plays a remarkable role while obtaining the quality patterns required, evaluating its system functions and making its suceces last longer, among other advantages. That is why a documental system establishment was carried out at the Inmunology and Bioprepared Products Center, as a part of the quality system establishment acording to NC-COPANT-ISO 9002:94 and NC 26-211:92.
The main results obtained were the definition of the types of documents to be made at the center, as well as their hierarchy; also, the definition of the main processes of documentation; the making of the Quality Handbook and the standarized operation procedures. The use of the main procedures and the quality system records were established too.
Key Words: documentation, quality system, ISO 9000, Good Manufacturing Practices.
INTRODUCCIÓN
El Centro de Inmunología y Biopreparados, enclavado en áreas de la Facultad de Ciencias Médicas de Holguín, surgió como un laboratorio asistencial de Inmunología en el año 1985 y fue desarrollándose hasta convertirse en suministrador de hemoderivados de origen animal tanto de los centros asistenciales de la provincia como del polo Oeste de La Habana.
Desde finales del año 1996, en este centro se comenzaron a dar pasos en la creación de una cultura de calidad que permitiera la implantación de un sistema de gestión de la calidad acorde con las normas ISO 9002 y las Buenas Prácticas de Producción Farmacéutica.
Como parte de este proceso de cambio organizacional surgió la necesidad de realizar el presente trabajo, que tiene como objetivos el diseño e implantación de un sistema documental capaz de servir como soporte al sistema de gestión de la calidad del centro.
Para cumplimentar estos objetivos se decidió aplicar el enfoque de procesos1, y la metodología para la implantación de un sistema documental ISO 9000 propuesta por María Elena Portuondo 2, . además de emplear la técnica de benchmarking competitivo tomando como referencia el Centro Nacional de Biopreparados, entidad líder en el trabajo por la calidad dentro del sector farmacéutico.Teniendo en cuenta que documentar es “plasmar los documentos y datos en cualquier tipo de soporte ( videos, fotografías, escritos, gráficos, medio electrónico)” 3 y que un sistema de la calidad documentado debe describir las formas de operar de la organización para alcanzar la calidad, se acometió este trabajo siguiendo los siguientes pasos:
Se realizó la clasificación de la documentación como se muestra en la figura 1, dividiéndola en dos grupos de acuerdo con su función fundamental: regulatoria o de registro.
Dentro de la documentación regulatoria se ubicaron aquellos documentos que establecen formas de actuar como el Manual de la Calidad, los Procedimientos Normalizados de Operación, las especificaciones, etc; o cumplimentan requisitos legales, como las resoluciones de creación de la entidad y designación del director, organigramas funcionales, certificaciones legales, entre otros.
Dentro de los registros se ubicaron los registros maestros, que son aquellos que forman parte del expediente de los productos y los registros de calidad que no forman parte de estos expedientes y se relacionan con procesos generales de la organización.
Se estableció además la jerarquía de la documentación aplicando la NC-COPANT-ISO-10013:1994. , representándola en la pirámide de la figura 2.
El diagnóstico de la situación de la documentación posibilitó confeccionar el plan de elaboración de documentos, estableciendo así las responsabilidades y las prioridades por la elaboración en cada una de las áreas de trabajo involucradas. El comportamiento de la confección procedimientos normalizados de operación y registros se puede apreciar en el gráfico de la figura 3.
Para la determinación de los procesos fundamentales de la documentación se aplicó el enfoque de procesos (Gómez, J.R, 1998), y la metodología propuesta por Portuondo (1996), determinando los siguientes procesos específicos:
Se desagregaron estos procesos específicos en procesos unitarios quedando de la siguiente forma:
Gestión de la documentación técnica:
Revisión y aprobación
Liberación de documentos
Consulta de la documentación técnica:
Teniendo en cuenta este análisis se confeccionó el procedimiento PNO0.009 “Liberación de lotes”, que junto con el PNO0.002 “Control de documentos” regula el funcionamiento del sistema documental.
Se elaboraron además los procedimientos para el formato, contenido, redacción e identificación de los Procedimientos Normalizados de Operación (PNO0.001), las Especificaciones (PNO0.003), los Reglamentos (PNO0.004) y los Expedientes Maestros (PNO0.005), estableciendo así los requisitos a cumplir por estos documentos.
Se elaboró el Manual de la Calidad de acuerdo con la norma NC-COPANT-ISO-10013:1994, para lo cual se conformó el grupo gestor de calidad integrado por representantes de todas las funciones. Como parte del proceso de su escritura se determinaron la política y objetivos generales de la calidad en un trabajo en grupo con el Consejo de Dirección y se confeccionó la matriz de responsabilidades que se muestra en la tabla 1.La estructura del manual y su número total de páginas se puede observar en la tabla 2, que permite tener una idea de la forma en que fue concebido.
El proceso de implantación del sistema documental se llevó a cabo poniendo en práctica lo establecido en los documentos confeccionados, y recopilando la evidencia de lo anterior a través de los registros.
Figura 1. Clasificación de los documentos.
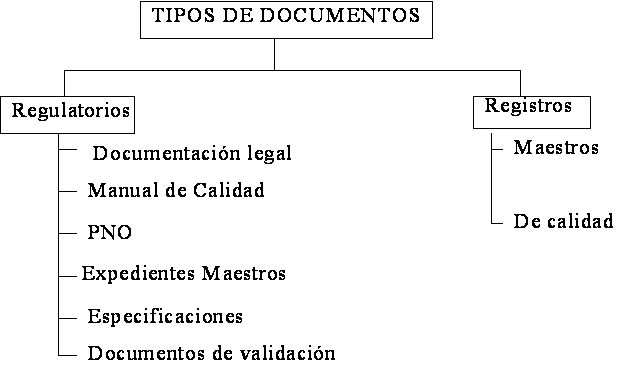
Figura 2. Jerarquía de la documentación.

Figura 3. Comportamiento de la elaboración de documentos en el Centro de Inmunología y Biopreparados.
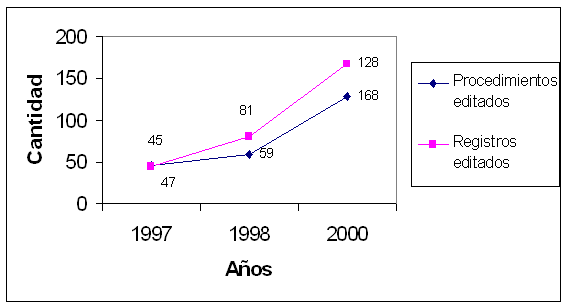
Tabla 1. Matriz de responsabilidades
|
Requisito |
Dirección |
Asistencia y
desarrollo |
Aseg.
de la calidad |
Producción |
Comercial |
Economía |
Admon |
|
4.1. Responsabilidad de
la dirección |
XX |
|
|
|
|
|
|
|
4.2. Sistema de la Calidad |
XX |
|
X |
|
|
|
|
|
4.3. Revisión del contrato |
|
|
X |
|
XX |
|
|
|
4.5. Control de la documentación
y los datos |
|
|
XX |
|
|
|
|
|
4.6.Compras |
|
|
|
|
X |
X |
XX |
|
4.8. Identificación y
trazabilidad de los productos |
|
X |
XX |
X |
|
|
|
|
4.9. Control de los procesos |
|
X |
X |
XX |
|
|
|
|
4.10 Inspección y ensayo |
|
|
XX |
|
|
|
|
|
4.11. Control de equipos
de inspección, medición y ensayo. |
|
X |
XX |
X |
|
|
|
|
4.12 Estado de inspección
y ensayo |
|
|
XX |
X |
|
|
|
|
4.13. Control de productos
no conformes |
|
|
XX |
X |
X |
|
X |
|
4.14. Acciones correctoras
y preventivas |
|
X |
X |
XX |
X |
X |
X |
|
4.15. Manipulación, almacenamiento,
embalaje, conservación y entrega |
|
|
XX |
X |
|
|
X |
|
4.16. Control de los registros
de la calidad |
|
|
XX |
|
|
|
|
|
4.17. Auditorías internas
de la Calidad |
|
|
XX |
|
|
|
|
|
4.18. Formación |
|
|
X |
|
|
|
XX |
|
4.19. Servicio posventa |
|
|
X |
|
XX |
|
|
|
4.20. Técnicas estadísticas |
|
X |
XX |
X |
|
|
|
|
Leyenda:
XX Responsable X Participa 1er
sustituto del Director: Jefe de asistencia y desarrollo 2do
sustituto del Director: Jefe de Producción 3er sustituto del Director: Jefe de Aseguramiento
de la Calidad |
|||||||
Tabla 2. Estructura del Manual de Calidad del Centro de Inmunología y Biopreparados.
|
|
Página |
|
Introducción.......................................................................................................... |
1 |
|
Objetivos
y alcance. Terminología...................................................................... |
2 |
|
Gestión
del manual de calidad............................................................................. |
3 |
|
Declaración
de la dirección................................................................................. |
4 |
|
Presentación
de la organización........................................................................... |
5 |
|
Capítulo
I. Responsabilidad de la dirección........................................................ |
6 |
|
Capítulo
II. Sistema de la Calidad....................................................................... |
9 |
|
Capítulo
III. Revisión del contrato...................................................................... |
11 |
|
Capítulo
IV. Control de documentos.................................................................... |
12 |
|
Capítulo
V. Compras............................................................................................ |
15 |
|
Capítulo
VI. Productos suministrados por el cliente............................................ |
16 |
|
Capítulo
VII. Identificación y trazabilidad de los productos................................ |
17 |
|
Capítulo
VIII. Control de procesos...................................................................... |
18 |
|
Capítulo
IX. Inspección y ensayos....................................................................... |
19 |
|
Capítulo
X. Control de equipos de inspección, medición y ensayo...................... |
20 |
|
Capítulo
XI. Estado de inspección y ensayo........................................................ |
21 |
|
Capítulo
XII. Control de productos no conformes................................................ |
22 |
|
Capítulo
XIII Acciones correctoras y preventivas.............................................. |
23 |
|
Capítulo
XIV Manipulación, almacenamiento, embalaje, conservación y entrega........................................................................................... |
|
|
Capítulo
XV. Control de los registros de calidad................................................ |
25 |
|
Capítulo
XVI. Auditorías internas de la calidad.................................................. |
26 |
|
Capítulo
XVII. Formación................................................................................... |
27 |
|
Capítulo
XVIII. Servicios postventa.................................................................... |
28 |
|
Capítulo
XIX. Técnicas estadísticas................................................................... |
29 |
|
Anexos................................................................................................................. |
30 |
CONCLUSIONES
El presente trabajo permitió el diseño e implantación de un sistema documental acorde con las normas ISO 9000 y la Buenas Prácticas de Producción Farmacéuticas en el Centro de Inmunología y Biopreparados de Holguín, como un paso más dentro del proceso de implantación del sistema de gestión de la calidad.
Su mantenimiento y desarrollo permitirá al centro contar con una herramienta indispensable para la toma de decisiones y con un punto de partida para el mejoramiento continuo.
BIBLIOGRAFÍA
Correspondencia: Zulem Pérez Rodríguez,
Ave. XX Aniversario Piedra Blanca Holguín. Teléfono: 48 1302 E_mail:
zulem@uho.hlg.edu.cu